高中化学平衡那里有点乱,有很多原理都是背的,我可不可以学一下大学化学明白一下原理?
我用两个反应,让你知道什么是化学反应原理
化学选修4叫什么↓

化学选修四叫做化学反应原理,不是背书的课程。
比起易错点,更重要的应该是把握化学反应的原理。
只来一个反应,把反应原理讲清楚。
第一个问题,反应是如何发生的?
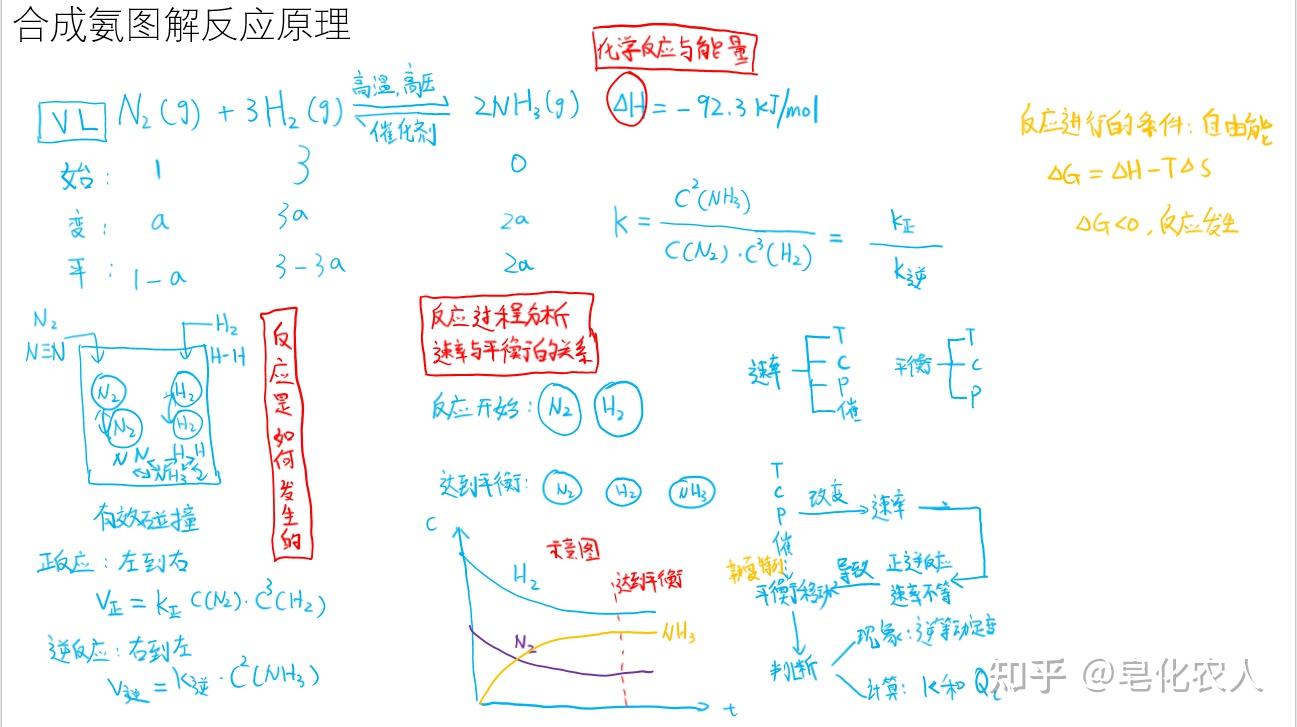
有效碰撞理论!(2019新人教版选择性必修1 P25-26)
反应由基元反应组成,基元反应的先决条件是反应物的分子发生有效碰撞。
有效碰撞理论来理解反应发生很不错,但是拿来判断,就不太得了。
这时来了一个新东西,叫吉布斯自由能。
反应就能进行,很好的判断方法。
第二个问题,反应进行的快慢谁决定?
联想物理中的运动的快慢,
那么化学反应的快慢也可以这么算,反应物消耗量和生成物的生成量,并且由于反应有正反应和逆反应两个方向,因此有正反应速率和逆反应速率两种速率,都用下面式子计算。
正反应速率是反应物浓度的消耗量,逆反应速率是生成物浓度的消耗量。
现在只是定义了速率计算公式,具体到一个反应中,要怎么计算呢?
答案是,三段式

例如,氮气在 时间内的正反应速率
同样,由于 是一段时间,因此这个反应速率是平均速率。这是一个定义式,从定义式里面,我们不知道谁决定了反应的快慢。
这里又要回到第一个问题里面提到的有效碰撞理论,你可以这么想,是不是碰撞得越快,反应就会越剧烈,从而反应速率越快。
那么,怎么才能使反应碰撞的越剧烈呢?
中国有句俗话,叫做人多屁股乱。一定空间内,人越多,越容易出问题,越容易碰撞,一定空间内的反应物多少怎么衡量?
用反应物的浓度来衡量,浓度越大,瞬时反应速率越快
压强也是一个道理
浓度越大,压强越大,所以,压强越大,瞬时反应速率也越快。
继续来思考,还是这一群人,关在密闭空间,温度越高越烦躁,越容易发生冲突,换言之就是发生反应越快。因此,温度越高,瞬时反应速率也越快。
还是这一群人,关在密闭空间,扔进去一块黄金,懂得都懂,抢啊。这就打起来了,反应发生,速率很快。因此,加入催化剂能够改变化学反应的速率。
总结一下,TcP催,四个因素会影响化学反应的瞬时速率。
以上都是反应的瞬时速率表达式。
看到这里,你肯定会有疑问,前面的k正、k逆是什么?浓度上面的指数是什么?
- k正、k逆是反应的常数,只受温度影响
- 浓度上面的指数是方程式对应物质前面的计量数
到这里,终于知道反应的快慢受谁影响了吧。
既然是可逆反应,并且反应物浓度不断减小,正反应速率不断减小;同样的生成物浓度不断增大,逆反应速率不断增大。那么会不会反应进行到一定程度,正逆反应速率相等,反应就不进行了。

那么这个反应进行的程度到多少,迫切关心,进行的越大,生成物越多,产品越多,赚钱越多,爽歪歪。
下一个问题应运而生。
第三个问题,反应进行的程度到多少?
又回到我们的三段式,反应进行了多少。也可以说是平衡时反应进行到什么程度了。

定义一个新的指标,叫做平衡转化率,简而言之,就是反应掉了多少物质,反应得多就是反应进行程度大。
这个数值越大越好。
可是平衡转化率是测量出来的,只是用来计算反应转化了多少的反应物,并没有告诉我们反应什么情况下会达到平衡。
还记得平衡标志吗?
正逆反应速率相等,逆等动定变。
这样就达到平衡了。
看起来有点别扭,来移个项。
定义这个比值叫化学平衡常数K,每一个反应都有他的平衡常数,这个比值等于某一个定值,实验做出来也是这样。
那么,我们的问题就回答完了,反应会进行到与平衡常数K的比值相等为止。且平衡常数K只受温度的影响,跟前面说的 和
有关系。
人类的欲望总是无法满足的,氮气和氢气太多了不值钱,氨气可以拿去做化肥,这个来钱,如果氮气和氢气能够反应完全,都变成氨气,赚大发了。并且反应的速率还要快,早日赚钱,早日买房。
黑手开始伸向对反应的控制了,怎么使化学反应又快,进行的程度又大,下一个问题。
第四个问题,反应如何调控?(控制速率,控制平衡移动)
还是这个反应,反应已经达到平衡了,我想要让反应往右移动,产生更多的氨气,是不是只要提高正反应速率就可以了,只要正反应速率大于逆反应速率,平衡就会往又移动。
提高氮气的浓度,提高氢气的浓度,增加 平衡向右移动。
的增加看
,如果反应是放热反应,就要降低温度,反应才能向右移动。
催化剂同等影响正逆反应速率,不影响平衡移动。
熟悉吧,勒夏特列原理
如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。
总结一下,改变速率找TcP催,改变平衡找TcP,速率的相对大小影响平衡的移动。平衡常数很重要。
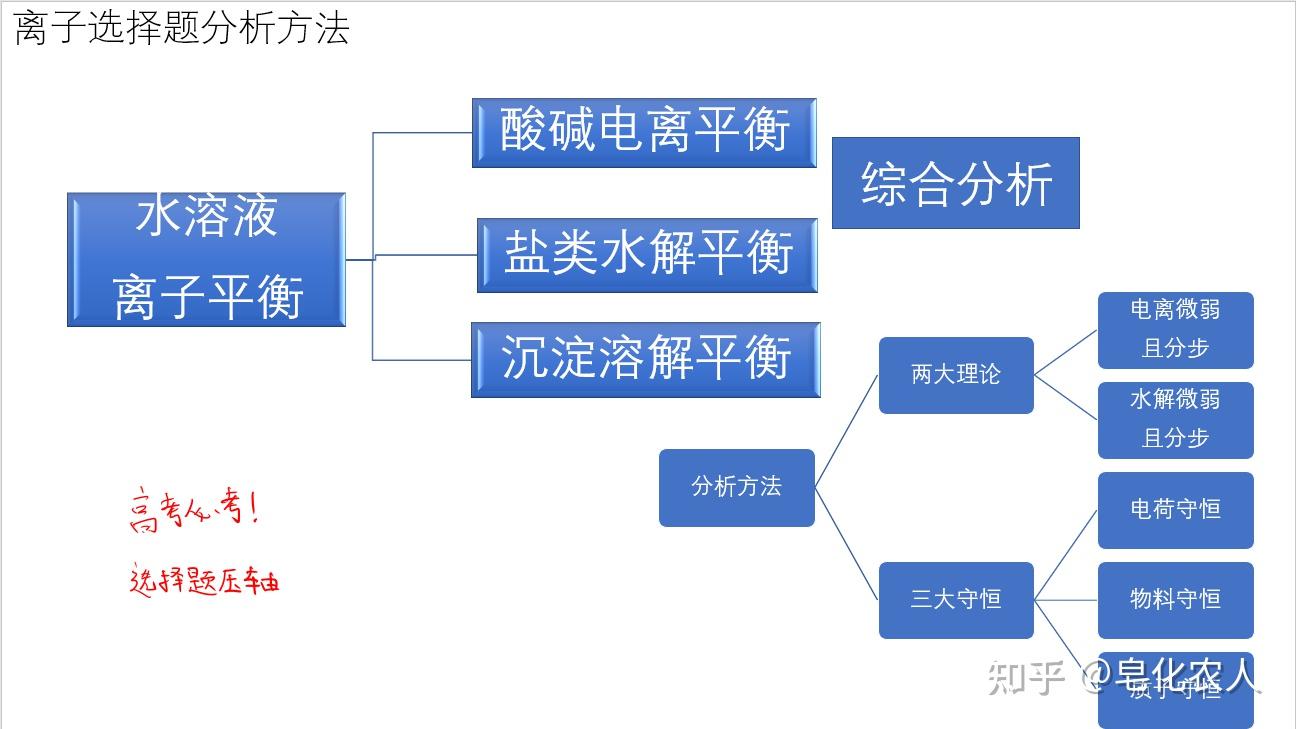
第五个问题,拓展到水溶液中的离子平衡
只讲原理,从一句俗语叫强酸制弱酸的开始。理解了强酸制制弱酸,水溶液离子平衡对你so easy!
先来看看强酸怎么制弱酸的,来个最简单的,盐酸制碳酸
这个反应初中就学过,应该不陌生吧。
如果你只是会背,盐酸是强酸,碳酸是弱酸,在反应中碳酸不稳定易分解得到 和
,所以只能强酸制弱酸,那真是gg了。
难度慢慢上升,等着接招。
第一层,知道强酸和弱酸,是复分解反应
和
反应是复分解反应[1]
复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。
相互交换成分就得到 和
,
不稳定易分解得到
和
。因此就得到
。
并且观察到很多类似反应,都是由三大强酸(盐酸、硫酸、硝酸)反应得到弱酸(如碳酸等),这样就得到了强酸制弱酸的规律。
你是不是这么记下来的,强酸制弱酸。
第二层,会进行离子化处理,区分氧化还原反应和离子反应
离子反应在2019人教版高中化学必修第一册第一章第二节。氧化还原反应在2019人教版高中化学必修第一册第一章第三节。
是难溶电解质,
溶于水后生成
和
,
会和
中的
发生反应结合生成
,
不稳定易分解,因此得到
。
反应原因是 和
不能共存,思考角度变成找不能共存的离子,只要他们不共存,必然会发生反应。
来一个这个, ,是弱酸制强酸,也与规则不同,生成了沉淀,反应仍然能够进行。你会说,这个是氧化还原反应,类型不同,跟强酸制弱酸无关。
那我们换另一个很熟悉的反应 ,离子反应,弱酸制强酸了吧,与规则不符,可是生成了沉淀,反应仍然能够进行。
第三层,会运用平衡分析
还是我们的 ,你会不会疑惑,
不是难溶电解质吗,哪来的
?
这就要看看化学反应原理了,2019人教版化学选择性必修1第三章第四节沉淀溶解平衡。
难溶电解质其实也可溶,只是溶解度很小,达到了溶解平衡
,溶度积为
所以溶液中的碳酸根离子是这么来的, 和
反应会生成
,使得溶解平衡不断向右移动,反应进行。
这只是解决了为什么会有碳酸根的产生,可是为什么 和
反应会生成
,还没有说清楚。
同样看化学反应原理了,2019人教版化学选择性必修1第三章
其实就是氢离子跟碳酸根结合而不跟氯离子结合,为什么?
因为氯离子不会水解,而碳酸根会水解,其实不是结合,是影响平衡移动。
与
反应生成
,反应不断正向进行,生成
,
不稳定易分解,得到
和
,又得到了
。
这个看似简单的反应,结合了沉淀溶解平衡,水解平衡,电离平衡,没想到吧!
来试试这个
提示:硫化氢电离平衡,两步。硫酸铜完全电离。生成沉淀,所谓的硫酸强酸只是剩下来氢离子和硫酸根的而已,铜离子抢走了剩下的自然是氢离子和硫酸根离子。
第四层,反应进行条件吉布斯自由能
再加深一层,强酸制弱酸这条规律,其实课本并没有,但是每个老师都会讲。
为什么在高中普通化学课程中弱酸不能制强酸?
其实问的是反应是否能发生,反应能否发生看啥?
吉布斯自由能!

想看自己看就好,2019人教版化学选择性必修1 P43,化学反应进行的方向。
总结一下
你肯定会说,我只是想知道弱酸为啥不能制强酸,或者说是强酸制弱酸这条规律怎么来的。
你讲了这么多原理,我都晕了。
答案老是说弱酸不能制强酸,这么写是因为大部分情况下是适用的,不然写太多解释性的话,答案页数就多了,价格就贵了,你就不买了!
并且懂这么多原理,我还是不会做题,有屁用。
会出现弱酸制强酸这类字眼,必然是跟方程式有关的题目,给我看↓
高中化学金属非金属真的要背所有反应方程式吗?
原电池电解池是氧化还原反应的应用,不算反应原理,不讲了。高中化学回归课本-P3-化学反应原理so easy_哔哩哔哩_bilibili
 新公网安备 65010402001845号
新公网安备 65010402001845号