疫苗是如何研制的?
一、疫苗作用机制及分类
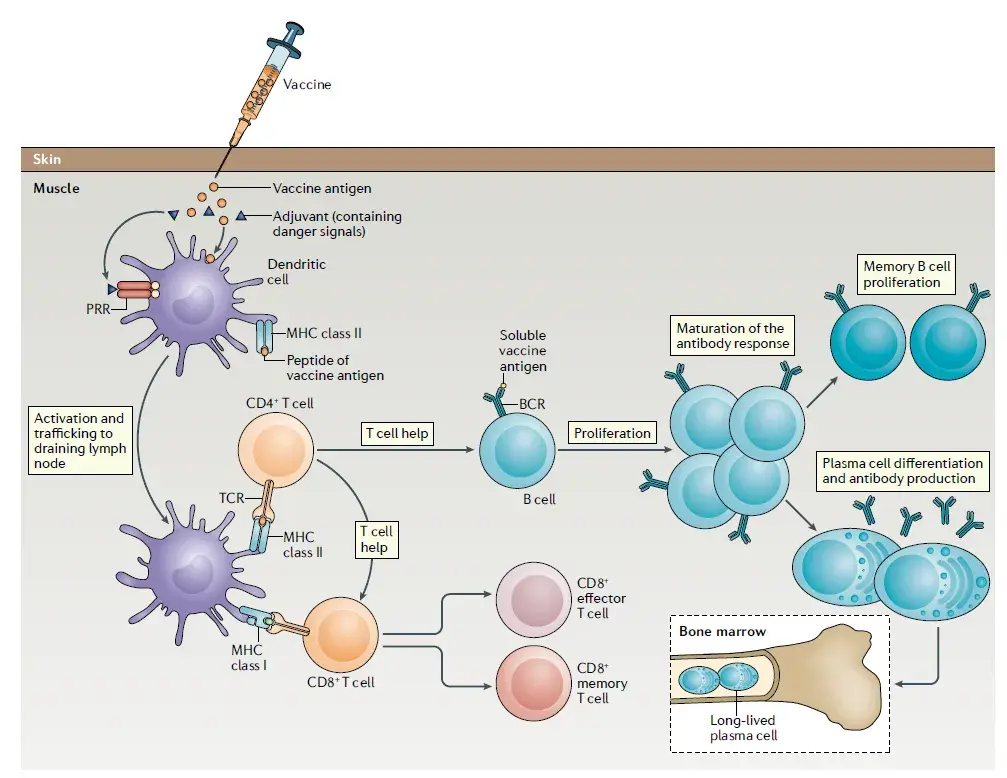
疫苗和自然感染一样,通过引发先天免疫反应来发挥作用,进而激活特异性抗原适应性免疫反应[1]。先天免疫是第一道防线,响应快速,但特异性不强,并且没有记忆功能[2]。适应性免疫是第二道防线,具有极其多样化的淋巴细胞和抗体,能够识别和消除几乎所有已知的病原体。每个病原体(或疫苗)表达(或含有)诱导细胞介导免疫的抗原,通过激活高度特异的T淋巴细胞亚群和刺激B淋巴细胞产生特定抗体来诱导体液免疫。在消除病原体后,适应性免疫系统通常会建立免疫记忆,当再次感染同一病原体时可以迅速重新激活[1]。
疫苗根据其不同的生产过程及在体内的作用途径不同可以分为多种不同的类型。疫苗可能包含减毒活病原体(通常是病毒)、灭活的完整病原体、毒素类似物(细菌产生的引起疾病的毒素的灭活形式)或病原体部分(如天然或重组蛋白质、多糖、结合多糖或病毒样颗粒)等[3],致病病毒相关疫苗的分类见下图1和表1[3-5]。
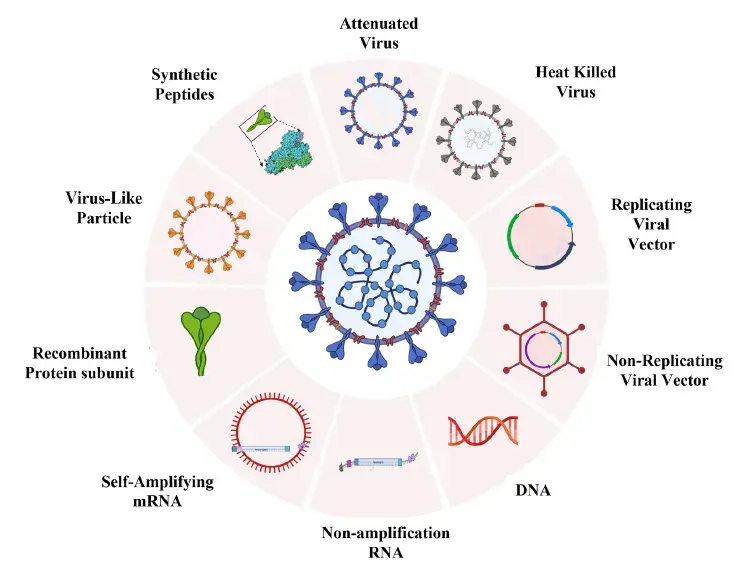
表1 . 不同类型致病病毒疫苗的优点及局限性[3-5]
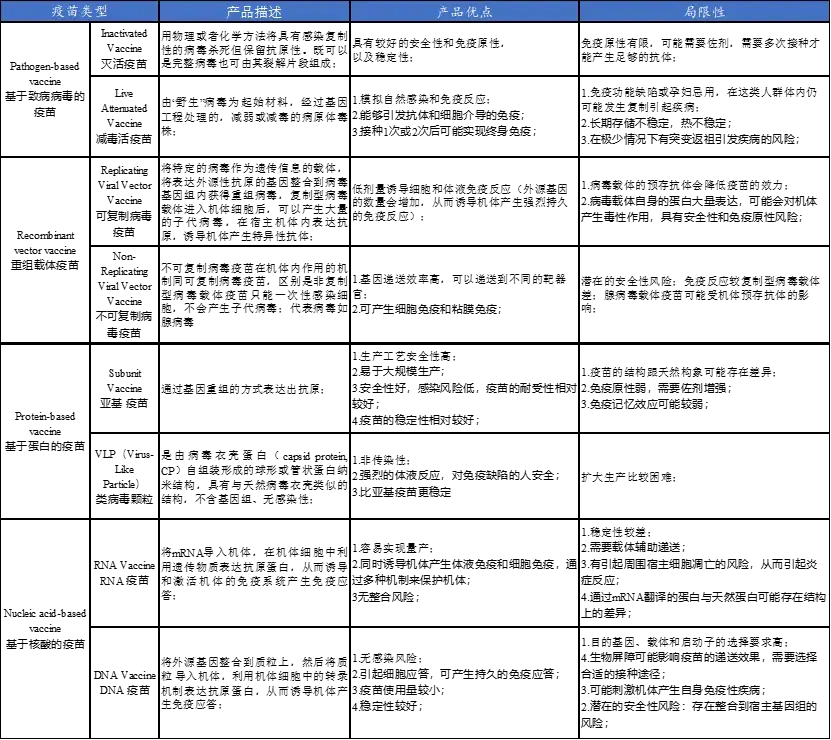
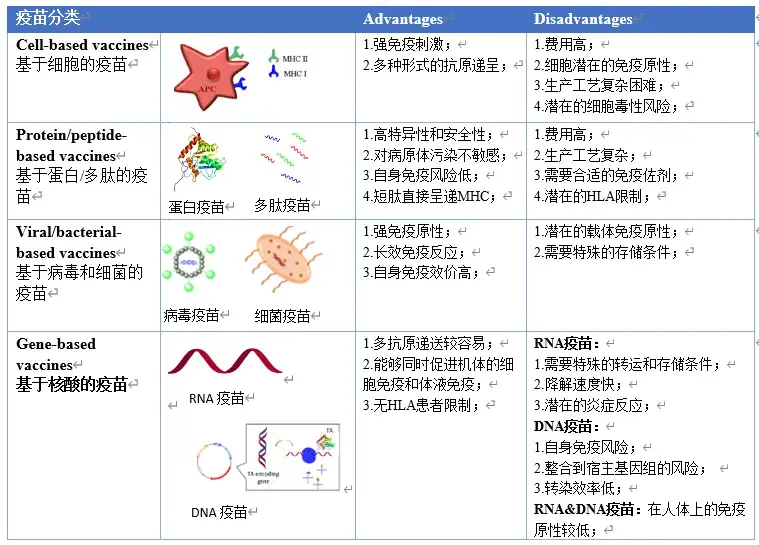
在过去的几年中,免疫疗法作为肿瘤新的治疗方向越来越受关注,肿瘤疫苗为新型疫苗的应用方向,可以“训练”免疫系统识别和消除癌细胞[6]。根据肿瘤疫苗的制备技术,可以分为四类:核酸疫苗(DNA、RNA疫苗)、细胞疫苗(DC细胞疫苗,或者完整肿瘤细胞)、病毒载体疫苗和蛋白/多肽疫苗(表2)[7-9]。
表2 . 不同类型肿瘤疫苗的优点及局限性[8]
二、疫苗产品非临床安全性评价研究要点和关键因素
非临床研究是药物研发的重要组成部分,可提供药物的安全性与有效性信息。安全性评价是疫苗非临床研究的重要组成部分,贯穿非临床试验、临床试验和上市后评价。
由于疫苗产品的种类很多,根据其不同的作用机制及产品类型,各监管机构都根据其特点颁布了相应的法规,总结见附录1。
临床前动物安全性评价的主要目的系通过相关动物来考察疫苗的安全性,包括对免疫器官和其它毒性靶器官的影响、毒性的可逆性,以及与临床相关的参数,预测其在大规模人群中使用时可能出现的不良反应,降低临床试验受试者和临床使用者承担的风险,并为临床试验方案的制订提供依据[10]。
结合不同类型疫苗在体内的作用机制,其可能导致的毒性反应主要包括,制品成分本身作为毒性物质对机体的直接损伤、诱导免疫系统引起的与免疫相关的毒性,以及污染物和残余杂质引起的毒性。由于疫苗系通过诱导免疫系统产生抗体及/或效应细胞发挥作用,因此其最主要的潜在毒性来自与免疫系统相关的毒性[11]。
2.1 疫苗产品非临床安全性评价研究要点
传统疫苗的非临床测试主要集中在动物的功效研究和疫苗配方的“安全通过”。随着时间的推移,非临床安全性测试的范围大大增加,并根据当前的指南要求对候选疫苗进行完整的毒理学研究。对于候选疫苗(包括新型疫苗)的非临床安全性研究符合以下总体原则表3[12]:

毒理学评估,主要是检测疫苗再局部和全身毒性方面的潜在安全性风险。指导原则允许根据疫苗的不同类型,适用人群,临床用量等方面在设计试验方案时具有一定的灵活性。
毒理学评估的目的是检测疫苗制剂中所有组分以及诱导的免疫反应的毒性。毒理学研究提供的信息可能有助于确定临床研究中的安全起始剂量,并确定任何潜在的毒性或靶器官。需要注意的是,在动物中的效果并不总是能够预示在人类中可能出现的效果,并且在某些亚群体中出现的罕见毒性只能在临床研究中检测到。但是,毒理学研究为疫苗开发提供了重要的安全数据。
三、疫苗产品临床前生物分析策略
3.1 疫苗类产品的PK和生物分布
疫苗的体内代谢一般不检测,但如果疫苗在体内产生可检测的活性产物(如表达细胞因子),且活性产物表达水平的变化可能具有临床意义,则有必要制定PK研究计划。因此,PK研究应视疫苗的具体类型而定,建议申办者根据自身产品的特性和作用机制进行相关的研究[13]。
对于核酸类疫苗(DNA和RNA疫苗)和以病毒为载体的活疫苗必要时需考察目的基因和病毒载体在体内的分布情况,持续时间等[14-16]。对于这类疫苗的PK研究可以采用qPCR或RT-qPCR,ddPCR,bDNA等技术,在拟定时间点解剖动物后检测组织脏器中靶抗原核酸的水平。
此外,对于mRNA疫苗,由于mRNA自身序列结构的体内稳定性差,免疫应答及自发跨膜效率低等因素,通常需要合适的递送系统将mRNA 递送入机体细胞并表达相应的抗原,经抗原呈递细胞呈递后引发机体免疫反应[17,18]。mRNA 递送载体对于mRNA 疫苗的稳定性和免疫应答至关重要。若疫苗组分中包含有新型的递送载体时,应考虑对新的组分单独进行全面的非临床安全性评价[19]。
此外,疫苗类产品可能包含佐剂成分,或使用免疫增强药物(如细胞因子)来增强针对抗原的特异性免疫反应。佐剂疫苗一般不需进行药代动力学研究 ,但 对于新佐剂,应根据佐剂特点、佐剂疫苗的预期使用和佐剂/全新成分的生物分布研究信息等评估开展药代动力学研究的必要性和可行性。对于可能被大量吸收或者生物转化的佐剂/全新成分,需要提供药代动力学研究数据[20]。
3.2 疫苗类产品的免疫原性分析
如前面介绍,疫苗可以通过激活免疫系统来诱导针对病原体的特异性抗体和/或细胞介导的免疫反应。疫苗诱导这种反应的能力被称为免疫原性。为了变得有效并产生持久的免疫力,疫苗需要正确激活先天性和适应性免疫反应,以产生病原体特异性记忆T和B细胞以及长期存活并能产生大量抗体的浆细胞。在随后的感染中,这些记忆细胞将快速分化为效应T细胞和/或产生中和抗体。
另一方面,疫苗中的一些组分也可能会引起针对非免疫接种目标抗原的免疫反应,产生致敏淋巴细胞,影响药效并产生毒性,这类反应也被称为免疫原性。
免疫原性试验主要考察疫苗在动物体内引起与人体相关的体液免疫或细胞免疫应答。
疫苗的免疫原性分析主要考虑以下几个方面:
- 1. 体液免疫原性:
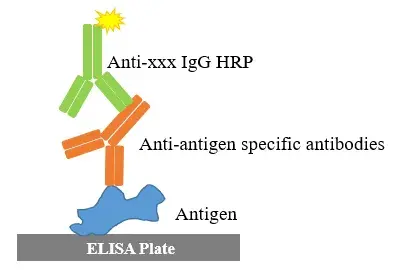
①检测动物血清/血浆中“抗原”特异性抗体。在某些情况下,应建立可区分同种型抗体的分析方法。例如,对于粘膜途径给药,通常涉及到IgA 抗体[21]。特异性抗体的检测,通常使用ELISA平台,如图2。
②对于含有递送系统的疫苗,比如脂质体或病毒载体(AAV等),需要考察递送系统的免疫原性;
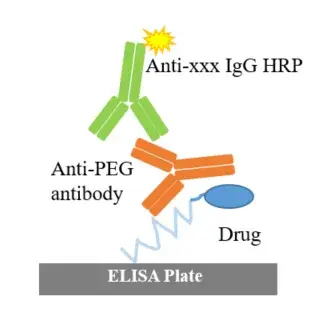
a.脂质体常作为核酸类疫苗的递送系统,LNP 通常由可电离脂类、天然磷脂、胆固醇和聚乙二醇(polyethyleneglycol,PEG)构成。PEG具有免疫原性,在体内会产生抗-PEG 抗体,具有一定的毒性反应[22];因此临床前安全性评价需要考察PEG的免疫原性;PEG的免疫原性检测通常使用ELISA平台,如图3:
b. 对于病毒类递送载体系统,通常需要考察病毒载体本身可能引起的毒性反应;腺相关病毒(AAV)常作为核酸类疫苗的递送系统,但由于其具有一定的免疫原性,因此在临床前安全性评估中需要考察AAV的免疫原性[23]。
中和抗体属于抗药抗体,中和抗体一方面会阻碍AAV载体进入细胞发挥药效,另一方面会增加免疫毒性风险。
中和抗体的分析根据药物作用机制和靶点选择合适的检测方法。其中最常使用的方法是基于细胞水平的功能试验和基于非细胞水平的结合试验(例如基于ELISA平台,或者ECL平台),如图4。
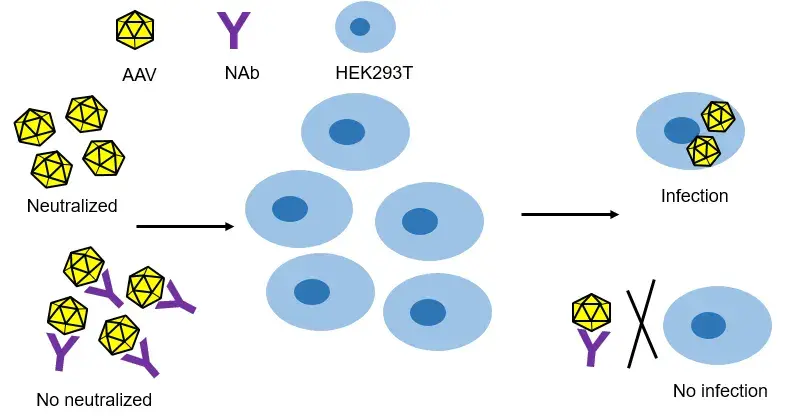
抗AAV中和抗体Nab检测基于细胞法,抗AAV中和抗体Nab检测基于细胞法,使用流式或生物荧光检测影响AAV进入细胞的抗体。可以进行预筛实验以及滴度检测。
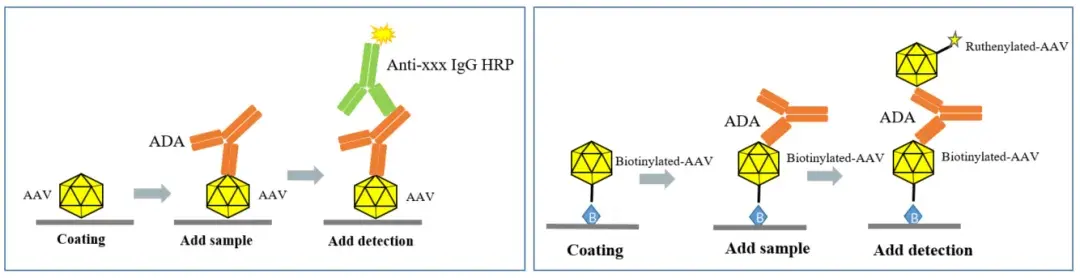
抗AAV抗药抗体Tab检测基于非细胞法,检测所有与该亚型AAV衣壳结合的抗体,它的分析一般分为三个层级,第一个层级为筛选试验,第二个层级为确证试验,第三个层级为滴度试验。检测平台可以选择ELISA或者ECL平台,如图5。
- 2. 细胞水平的免疫原性:
肿瘤疫苗是将肿瘤抗原以某种方式导入患者体内,激发或增强患者自身免疫系统,诱导机体产生长期的体液和细胞免疫应答和记忆,从而杀伤肿瘤细胞,作用机制如图6[24],选择合适的检测方法来评估细胞免疫反应至关重要。
a. 酶联免疫吸附斑点(ELISpot)技术是检测抗原特异性T细胞最常用的方法之一。也有越来越多的研究表明,ELISpot(IFN-γ)适用于多肽等疫苗治疗后的T细胞应答[25],检测原理如图7;
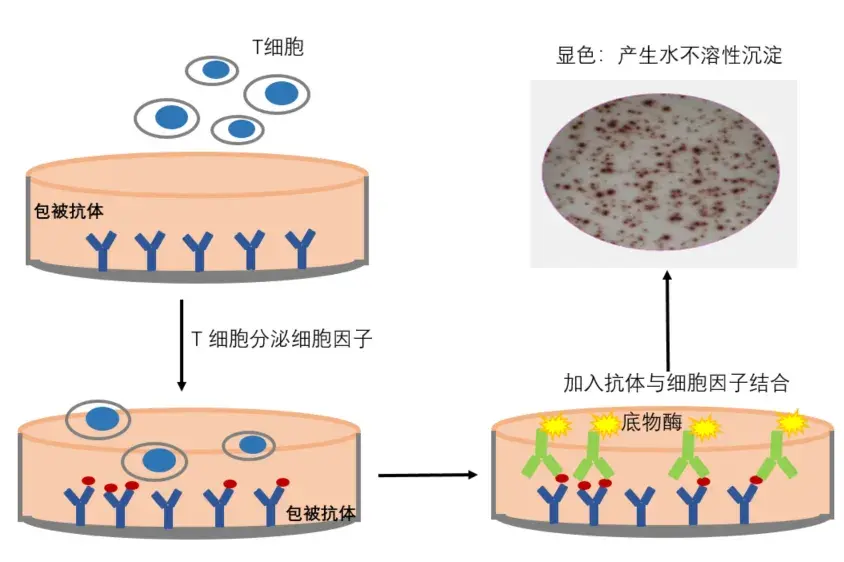
酶联免疫斑点技术(ELISpot)可以在单细胞水平对抗体分泌细胞(如B细胞)及细胞因子分泌细胞(如T细胞)进行检测,该方法有极高的灵敏度,可达20-25斑点/100万细胞,并且该方法能够对抗原刺激后的活细胞进行功能性检测,是疫苗领域药效评估的关键检测方法。
b. 基于流式细胞术的胞内细胞因子染色(intracellular cytokine staining,ICS)也是是评价疫苗诱导的细胞免疫应答常用的检测方法。
免疫细胞(PBMC)经特异性抗原刺激后会产生细胞因子,通过抑制细胞因子的分泌,令其经过一定时间的刺激后在胞内不断积累,再对细胞经过固定和破膜处理,孵育抗细胞因子的荧光抗体,通过流式细胞仪进行检测。
卡介苗(BCG)是唯一被批准使用的结核疫苗。虽然对结核病防护所需的细胞介导免疫尚未完全了解,但已知与包括CD4和CD8 T细胞在内的多种要素有关。卡介苗能够诱导1型辅助T细胞(Th1)反应,刺激CD4 T细胞产生干扰素-γ(IFN-γ)。卡介苗免疫原性的强弱与结核菌素(结核分枝杆菌的纯化蛋白衍生物 [ PPDs])特异性的干扰素-γ表达水平存在强烈的相关性,可以使用流式平台检测细胞内的IFN-γ表达,使用ELISA平台检测分泌到细胞培养上清的IFN-γ表达。
c.MHC四聚体检测技术(MHC Tetramer),该技术于1996年由美国斯坦福大学医学院的 John D. Altman 博士所开发,它在单细胞水平上标记目标 T 细胞,并通过流式细胞术对细胞进行分析,从而成为一种快速、简便的检测抗原特异性 T 细胞(antigen-specific T cells)的定性及定量分析方法[26]。
MHC 分子在免疫应答过程中发挥着抗原识别的作用,主要功能是将抗原呈递给 T 细胞。大部分 T 淋巴细胞在其细胞表面表达单一的、高度特异性的抗原受体(TCR),通过抗原呈递过程与 MHC-抗原肽复合物相结合并识别其中特异的抗原肽,启动获得性/特异性免疫应答机制。
TCR 与 MHC-抗原肽复合物之间的亲和力低,半衰期短,相互结合后容易快速脱落。而 MHC-抗原肽复合物四聚体技术由 4 个 MHC-抗原肽单体分子及荧光染料组成的复合物,它以带有信号标记的链霉亲合素为基础,交联四个 MHC 分子单体,形成 MHC 四聚体;一个 MHC 四聚体分子可与同一 T 细胞表面的 3-4 个 TCR 相识别并结合,从而大大增强了 MHC-抗原肽复合物与 TCR 之间的结合力和检测特异性,并可通过流式细胞术成功实现对抗原特异性的 T 细胞的离体分析,如图8。

3.3 疫苗类产品的免疫毒性分析
疫苗的免疫毒性是临床前研究关注的重点,主要包括超敏反应、自身免疫等。由于疫苗系通过诱导免疫系统产生抗体及/或效应T细胞发挥作用,因此其最主要的潜在毒性来自与免疫系统相关的毒性[10]。疫苗的免疫毒性包括疫苗编码的抗原引起的免疫耐受性或自身免疫性、疫苗中污染的细菌蛋白是否引起抗体反应。
美国 FDA《以传染性疾病为适应症的质粒DNA疫苗的考虑要点》要求在进行临床前安全性评价时, 应将注射局部的反应原性和全身毒性反应相结合进行评价, 还应观察潜在靶器官包括血液和免疫系统的毒性反应以及疫苗表达的组织分布或对特定组织的倾向性与表达的持续时间。
疫苗的临床前免疫毒性通常考察细胞免疫表型分析,细胞因子,补体以及免疫球蛋白等检测类型,充分考察免疫系统相关的变化。
细胞免疫表型分析(Immunophenotype), 采用抗体进行白细胞亚型的鉴定和/或白细胞亚型的计数。免疫表型试验通常采用流式细胞术。流式细胞术可用来测定淋巴细胞的抗原特异性免疫应答。推荐采用各淋巴细胞亚型的绝对数量和百分比对给药相关的变化进行评价。
细胞因子分析(Cytokines),疫苗诱导的免疫毒性作用,需关注对疫苗诱导的保护性细胞因子和与毒性有关的炎症因子的检测和分析。
细胞因子释放综合征为免疫细胞过度活化,促炎性因子快速释放而导致的一组临床综合症,是免疫调节类药物普遍的不良反应,在一些疫苗药物中也可以观察到。
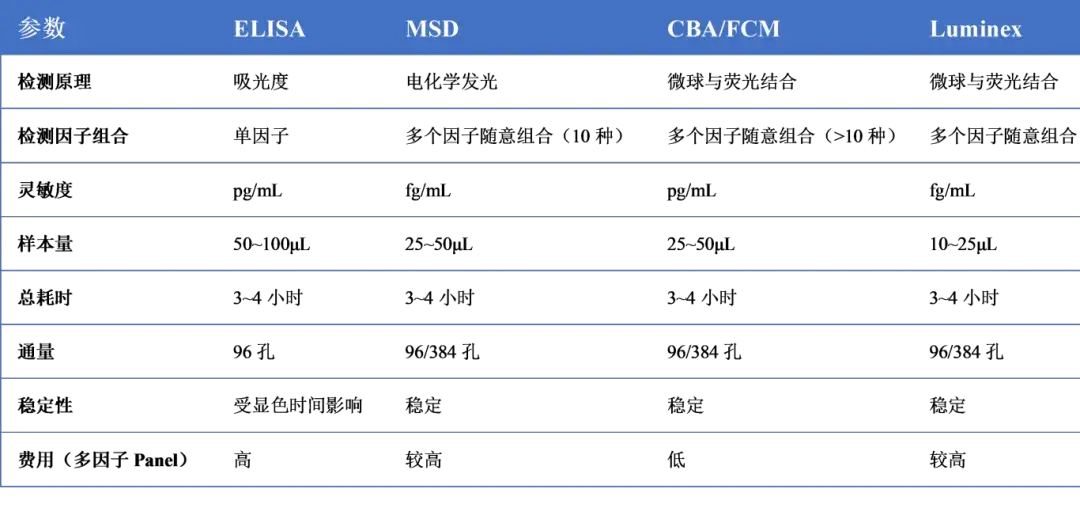
除了能使用ELISpot对于单种细胞因子进行特异性细胞免疫响应的检测,多种细胞因子检测也可基于MSD,CBA/FCM,Luminex,ELISA等多种检测平台,对实验动物或人血清中多种细胞因子同时进行检测。各平台细胞因子检测参数对比见表4。
表4 细胞因子不同检测平台参数对比
补体和免疫球蛋白分析,免疫球蛋白(IgA、IgE、IgM)、补体(如C3、C4)检查是评估机体免疫系统的重要指标,它们的升高或降低都会对免疫系统有一定的影响。IgA、IgM、IgE的分析可以用于评估疫苗对于固有免疫以及早期体液免疫的效应、检测疫苗给药后自身免疫反应、发现超敏反应的产生。补体能够与IgG Fc端结合,在疫苗接种后的固有免疫系统应答以及补体依赖的细胞毒性反应中发挥作用,也可用于超敏反应以及其他毒副作用的评估。因此评估免疫球蛋白和补体有重要意义。
目前,药明康德生物分析部已建立了多个不同种属(大鼠,小鼠,食蟹猴,小型猪,兔等)的免疫毒性评估的内部方法,可以根据待检测分析的目标物选择合适的分析平台,全面支持包括传统或新型疫苗,细胞和基因治疗产品在内的定量分析。
四、总结与展望
近年来,随着新疫苗、新佐剂和新给药系统的不断出现,以及疫苗接种人群日益扩大,疫苗的安全性逐渐成为一个日渐重要的问题。创新型疫苗进行临床前安全性评价现已成为国际上的共识。世界卫生组织(WHO)和欧盟均颁布了关于疫苗的临床前或非临床评价的指导原则。疫苗的安全性评价贯穿非临床试验、临床试验和上市后评价。疫苗的临床前安全性评价是以科学为基础的、具有内在逻辑关系的、渐进的研究过程,试验动物的选择和试验设计的科学性在很大程度上决定了临床前安全性评价的价值。
目前,药明康德生物分析部已建立全面的能力,支持不同类型疫苗的临床前生物分析:qPCR平台可以支持核酸类疫苗的药代动力学,组织分布等分析。MSD平台和ELISA平台可以支持疫苗体液免疫的特异性抗体以及递送载体本身免疫原性分析。ELISpot平台可以支持疫苗产品的细胞免疫相关的免疫原性评估;
另外,ELISA,MSD,Luminex及FACS平台均建立了针对不同动物种属丰富的内部方法,可以进行各种细胞因子,各种细胞亚型和生物标志物的分析,以便在临床前阶段更全面地考察疫苗类产品的生物有效性,免疫性毒性和安全性。同时,我们也将持续建设新能力,打造各种类型疫苗产品临床前研究的全面的一体化赋能平台。
如果您想咨询相关业务或者对其他业务感兴趣,欢迎点击如下链接,联系我们
参考文献:
[1]Siegrist C-A. Vaccine immunology. In: Plotkin SA, Orenstein WA, Offit PA, editors. Vaccines. 6th ed. Philadelphia, United States: Elsevier/Saunders; 2013. p. 14–32.
[2]Clem AS. Fundamentals of vaccine immunology. J Glob Infect Dis. 2011;3:73–78.
[3] Volker Vetter, Gülhan Denizer, Leonard R. Friedland, Jyothsna Krishnan &
Marla Shapiro (2018) Understanding modern-day vaccines: what you need to know, Annals of Medicine, 50:2, 110-120
[4] Chattopadhyay, A.; A. Abdul Kader, J.; Mandal, B.Exigency of Plant-Based Vaccine against COVID-19 Emergence as Pandemic Preparedness. Vaccines 2023, 11, 1347.
[5]宋全伟,王华庆.不同技术路线研发新型冠状病毒疫苗的特性和研究进展[J] . 中华医学杂志, 2020, 100(38) : 3030-3040. DOI: 10.3760/cma.j.cn112137-20200824-02454.
⤵️喜欢我们的内容,欢迎关注@药明康德市场部!或者点赞、评论、分享给其他读者吧!
 新公网安备 65010402001845号
新公网安备 65010402001845号